近日,BEBC团队发表题为“MechanomedicinePlatforms: Engineering Hydrogel Mechanics for Next‐Generation Vaccines”的综述论文。该研究系统性整合了机械药学与水凝胶材料交叉领域的前沿进展,深入剖析了力学工程化水凝胶疫苗的设计原理、作用机制及优化策略,为突破传统疫苗技术瓶颈、推动下一代疫苗革新提供了全面的学术参考与实践指引。
聚焦传统疫苗核心痛点
疫苗是预防传染病的关键手段,但传统疫苗平台普遍面临多重局限。灭活疫苗、重组亚单位疫苗、mRNA疫苗等传统技术路线,常存在抗原快速降解、免疫保护持续时间短、依赖冷链储运等问题,且在特殊人群适用性、应对变异病原体能力上存在明显不足。这些痛点严重制约了疫苗的全球可及性与防控效果,尤其在资源受限地区和特殊人群接种中面临诸多挑战。
该综述系统梳理了不同疫苗平台的性能差异,指出传统疫苗在稳定性、耐久性和适用性上的短板。例如,mRNA疫苗虽能诱导高强度免疫应答,但需零下70℃超低温储存;灭活疫苗虽适用人群广泛,却仅能提供约40%的长期保护效率。而力学工程化水凝胶平台通过跨学科融合生物物理学、材料科学与免疫学,为一站式解决这些难题提供了创新思路。
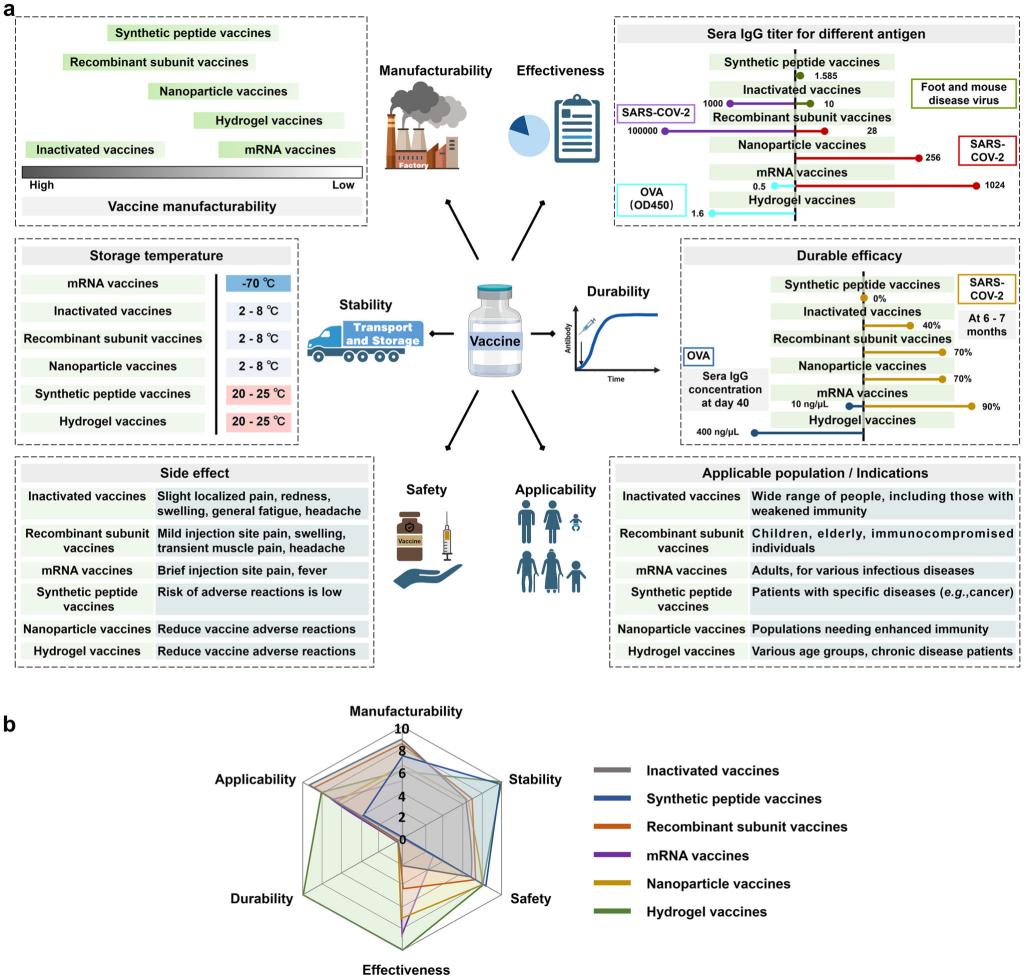
图1.水凝胶疫苗借助力学生物学原理超越传统疫苗平台:基于关键指标的疫苗平台对比评估。(a)针对六大关键参数的详细定量评估:可制造性、稳定性(储存温度)、安全性(副作用谱)、有效性(针对严重急性呼吸综合征冠状病毒2型、口蹄疫病毒和卵清蛋白(OVA)的抗体滴度)、持久性(6~7个月时的抗体保留率)以及适用性(适用目标人群)。(b)各类疫苗整体性能标准化指标的汇总雷达图。选用雷达图可实现多维度指标的同步可视化,直观对比不同疫苗平台的相对优劣。
解码力学调控疫苗免疫应答的核心机制
综述的核心突破在于系统阐明了水凝胶力学特性与免疫应答的精准关联机制,构建了“力学参数-力传导通路-免疫结果”的完整理论框架。
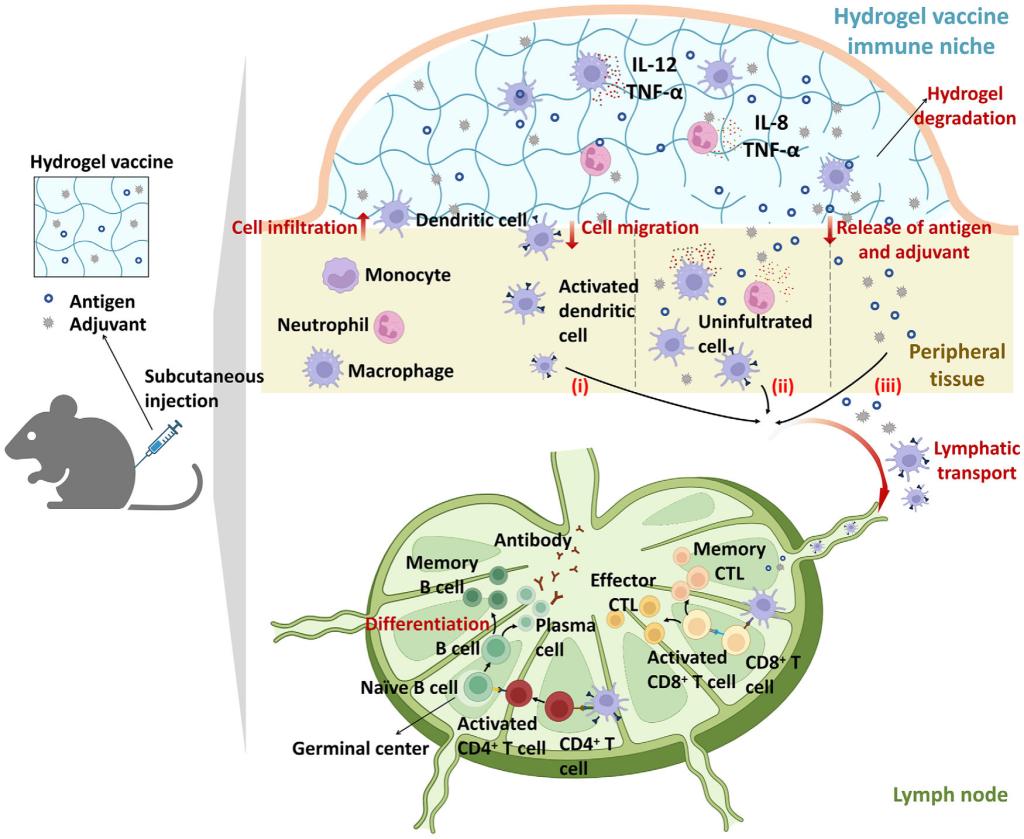
图2.水凝胶疫苗诱导机体免疫应答的核心机制水凝胶疫苗经皮下注射后激活免疫应答的三条关键通路:一是水凝胶内部免疫细胞(中性粒细胞、巨噬细胞、树突状细胞)直接识别抗原并启动局部炎症与免疫活化;二是水凝胶降解或扩散释放的抗原,与注射部位局部免疫细胞相互作用引发免疫反应;三是释放的抗原经淋巴循环转运至淋巴结,通过树突状细胞呈递抗原,进一步激活T细胞、B细胞分化,最终产生抗体和免疫记忆,实现长效免疫保护。
研究团队总结发现,通过精准调控水凝胶的刚度、粘弹性、孔隙率和降解动力学四大关键参数,可在注射部位构建稳定可控的局部免疫龛位。这种人工设计的微环境能形成抗原储存库,保护抗原免遭快速清除,模拟持续病原体暴露状态,延长抗原与免疫细胞的作用时间。同时,水凝胶的力学信号可通过整合素- FAK、Piezo1-Ca²⁺-NFAT及YAP/TAZ等关键力传导通路,直接调控免疫细胞的迁移、分化与活化,显著增强生发中心反应,诱导产生广谱、高亲和力抗体。
综述明确了最优力学设计窗口:刚度约0.5-10 kPa、粘弹性松弛时间100-1000 s、孔隙尺寸10-50μm的水凝胶,能最优化中性粒细胞浸润、树突状细胞成熟、巨噬细胞极化及T细胞活化等系列免疫过程,最终实现强效持久的免疫保护。
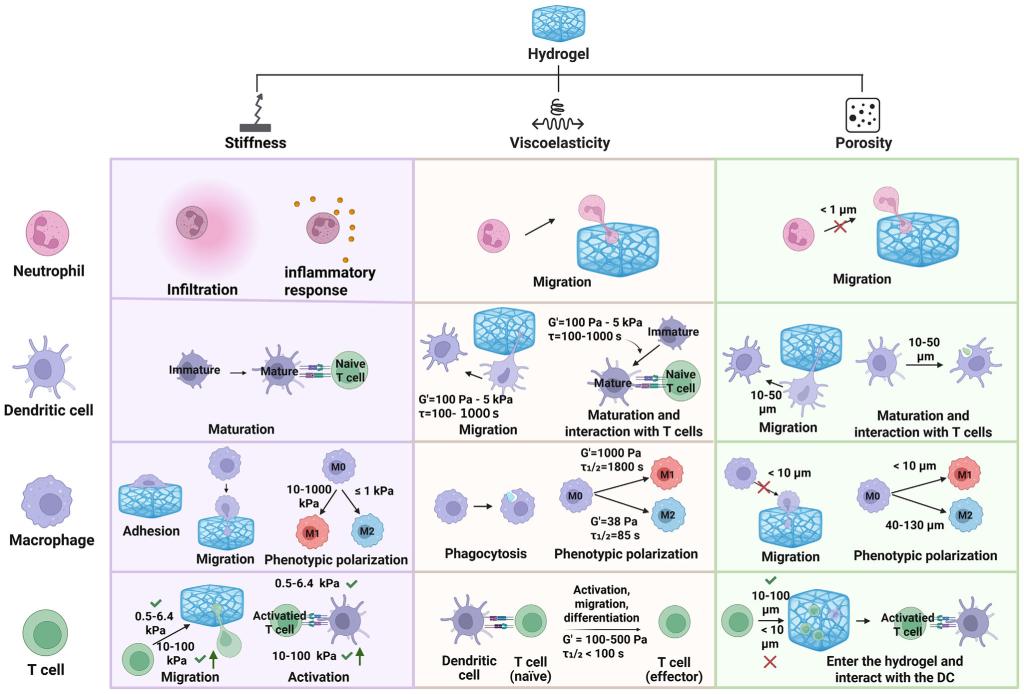
图3.水凝胶力学参数对免疫细胞功能的精准调控。系统展示了水凝胶关键力学参数(刚度、粘弹性、孔隙率)与不同免疫细胞(中性粒细胞、树突状细胞、巨噬细胞、T细胞)功能的对应关系。其中,刚度通过调节细胞浸润、成熟及表型极化影响免疫启动,粘弹性主导细胞迁移与相互作用效率,孔隙尺寸则直接决定免疫细胞的浸润可达性。当水凝胶刚度控制在0.5-10 kPa、粘弹性松弛时间100-1000s、孔隙尺寸10-50μm时,可协同优化中性粒细胞浸润、树突状细胞成熟、巨噬细胞M1/M2平衡及T细胞活化等关键过程,为局部免疫龛位的稳定构建提供力学基础。
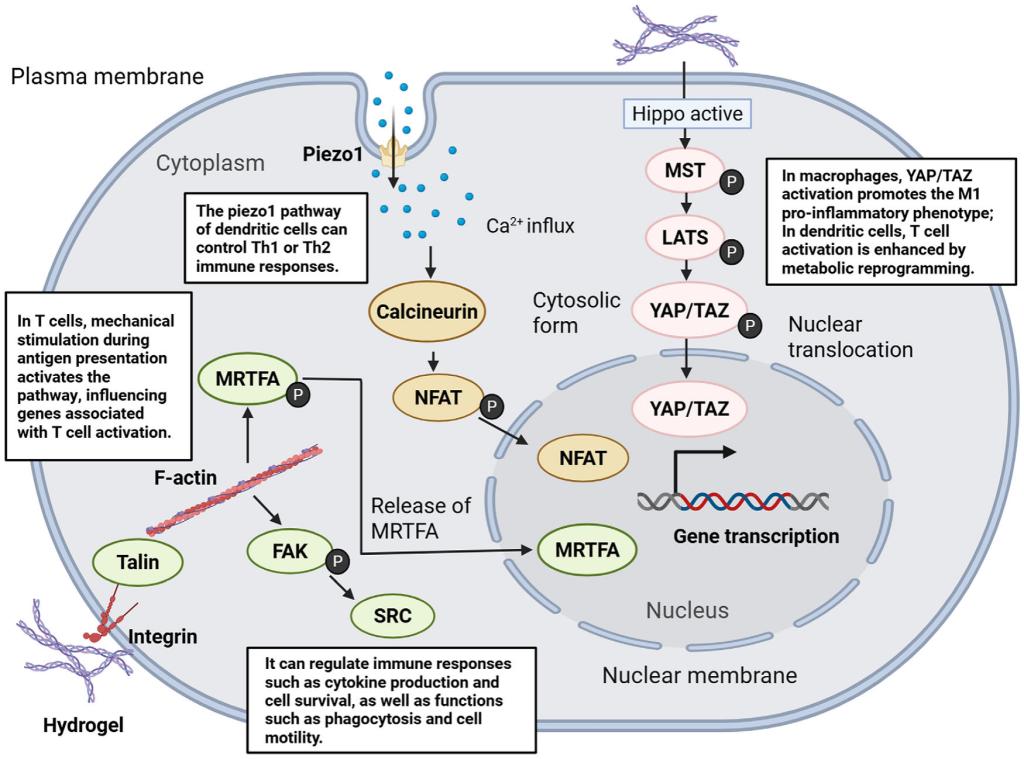
图4.水凝胶力学信号调控免疫应答的力传导通路。该图揭示了力学信号向免疫应答转化的核心分子机制。水凝胶的力学特性通过整合素- FAK、Piezo1-Ca²⁺-NFAT及YAP/TAZ三大关键通路,将物理信号转化为生化信号:整合素聚类激活FAK-Src通路,调控免疫细胞迁移与细胞因子分泌;Piezo1离子通道介导钙内流,激活NFAT通路促进促炎因子产生;YAP/TAZ转录共激活因子在力学应激下核转位,调控免疫细胞代谢与活化。三条通路协同作用,直接影响生发中心反应强度与抗体亲和力成熟,最终实现广谱、持久的免疫保护效应。
多维度呈现疫苗性能升级潜力
综述通过大量前沿研究案例,系统展现了力学工程化水凝胶在疫苗性能提升上的多维度优势。
在稳定性与可及性方面,水凝胶矩阵能限制疫苗成分的分子流动性,减少聚集降解,即使在65℃高温下仍能保持活性。经优化的水凝胶疫苗可在20-25℃室温条件下稳定储存运输,彻底摆脱冷链束缚,极大降低全球配送成本。在免疫效果上,水凝胶疫苗单剂接种即可激发持续超过1年的抗体应答,其生发中心B细胞数量较传统铝佐剂疫苗提升十倍以上,能有效诱导广谱中和抗体,应对病原体变异挑战。
在安全性与适用性上,剪切稀化和自修复特性的水凝胶可减少注射创伤,局部抗原递送能降低全身副作用,使婴幼儿、老年人及慢性病患者等特殊人群安全接种成为可能。同时,通过力学优化,水凝胶可适配注射、微针、鼻腔喷雾等多种给药方式,拓展了在大规模接种、微创免疫等不同场景的应用潜力。
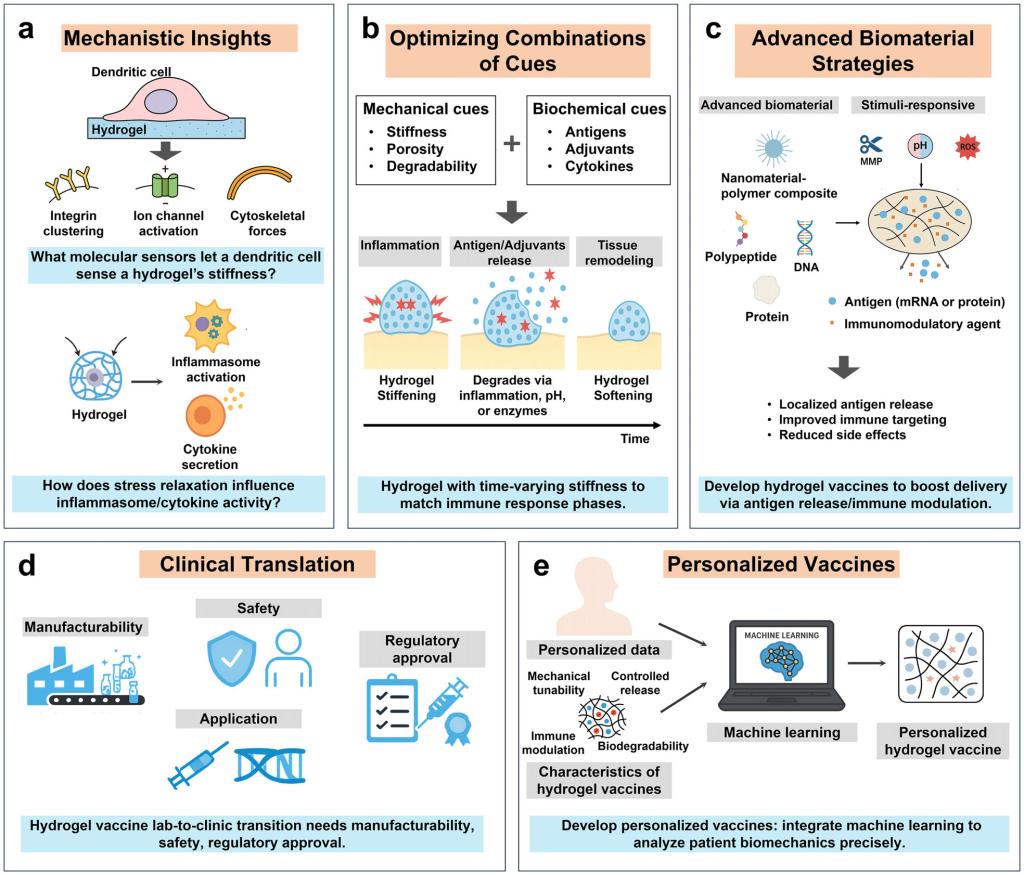
图5.水凝胶力学性能的工程化优化可提升疫苗效。(a)水凝胶高强度高韧性可提升加工性与生产效率,适宜弹性及抗疲劳性保障批次稳定性与一致性。(b)其刚度、粘弹性与孔隙率可调控免疫细胞行为,进而影响疫苗免疫效能。(c)调整交联密度与聚合物组成,可增强水凝胶稳定性,实现抗原长期完整保留。(d)刚度、粘度及降解特性控制抗原佐剂释放,决定免疫应答的时长与强度。(e)刚度与粘弹性可减少抗原渗漏及水凝胶降解,降低炎症与不良免疫反应风险。
勾勒未来发展与转化蓝图
综述最后提出了机械药学驱动疫苗创新的五大核心方向,为该领域的未来发展提供了清晰roadmap。
在机制研究层面,需进一步明确免疫细胞感知水凝胶刚度的分子传感器,以及应力松弛对炎症小体激活、细胞因子分泌的调控规律。在设计策略上,应注重力学信号与生化信号的协同整合,开发动态响应型水凝胶,实现免疫应答全过程的精准适配。在材料创新方面,可结合酶响应、pH响应等智能设计,拓展至mRNA等新型疫苗的递送系统。
临床转化层面,需重点解决规模化生产的稳定性、力学参数的质量控制标准,以及新型疫苗的监管分类等关键问题。个性化疫苗则是未来重要方向,通过无创成像技术量化个体组织刚度、淋巴流动速度等生物力学特征,结合机器学习优化水凝胶配方,可实现免疫效果的个体化精准提升。
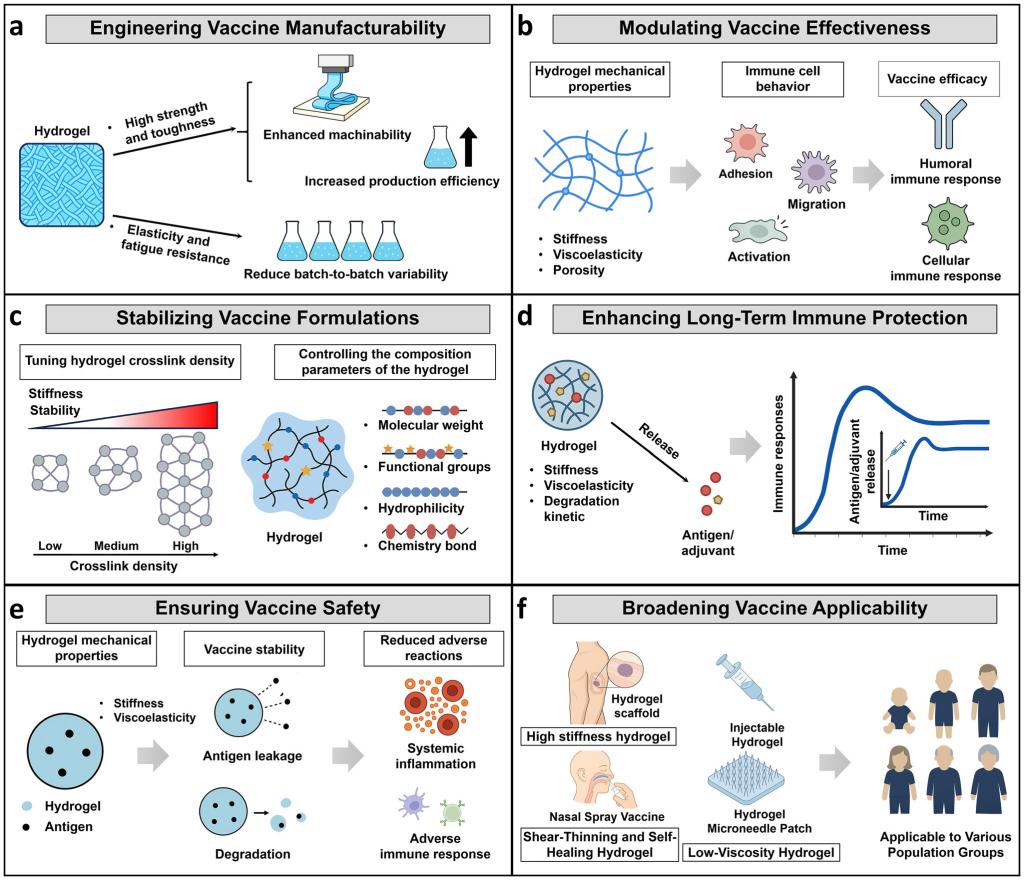
图6.核心方向与挑战如下:(a)机制解析:需明确水凝胶力学性能向免疫信号的转化机制,借力学生物学工具构建疫苗循证力学设计基础。(b)信号优化:力学与生化信号协同可获最佳免疫效果,刺激响应性材料的动态力学性能及佐剂阶段递送能增强免疫应答。(c)材料策略:新型水凝胶平台通过精准调控抗原释放与免疫功能,适配mRNA等多类疫苗,为精准免疫提供可能。(d)临床转化:需解决可制造性、安全性及监管问题,聚焦稳定生产、生物降解性与新评价标准建立。(e)个性化疫苗:结合机器学习分析患者生物力学特性,针对癌症类型与肿瘤微环境定制水凝胶,优化免疫激活效果。
文章链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202513783
作者简介
文章第一作者为西安交通大学医工交叉博士后杨梦思。通讯作者为西安交通大学第二附属医院郭卉教授、西安交通大学生命学院徐峰教授和魏钊研究员。该工作得到了国家自然科学基金、陕西省重点研发计划及西安交通大学青年拔尖人才支持计划等项目资助。
BEBC简介
西安交通大学仿生工程与生物力学研究所(BEBC)围绕“重大疾病诊治”领域中共性科学问题和技术挑战,按照“临床重大需求牵引-生物力学理论创新-医工核心技术突破-临床转化应用推广”的研究思路,创立了“多尺度生物热-力-电耦合学”,开拓了“力-医学”学科新方向。BEBC立足力学基础理论,交叉融合材料、化学、生物、医学等领域,按照“临床问题-实验室研究-临床应用”的研究思路,在力学微环境领域开展了从组织到细胞和分子尺度的多尺度生物热-力-电耦合学等基础和应用研究,为阐明重大疾病的发病机理和临床诊疗提供有效的理论指导和技术方案。相关成果发表于Nature Materials、Nature Chemistry、Nature Communications、Science Advances、PNAS等权威期刊。
力医学相关文献
腱骨界面力医学,《中华创伤杂志》
肿瘤力医学,《中华肿瘤杂志》
胰岛力医学,《中华糖尿病杂志》
线粒体力医学,《中华生物医学工程杂志》
胃力医学, 《中华消化杂志》
口腔力医学,《中华口腔医学杂志》
乳腺力医学,《中华肿瘤杂志》
生命物理学评论,《Physics of Life Reviews》
细胞力学智能,《力学进展》
口腔颌面力医学,《Translational Dental Research》
皮肤力医学,《中华医学杂志》
肝脏力医学,《中华消化外科杂志》
颌骨再生力医学,《Advanced Healthcare Mate》
创面修复力医学,《医用生物力学》
胰腺炎力医学,《中华胰腺病杂志》
眼力医学,《国际眼科纵览》
脂肪力医学,《Trends in Endocrinology and Metabolism》
跨时间尺度力学生物学,《Nature Reviews Physics》
机械药学疫苗,《Advanced Meterials》