
光热疗法(PTT)作为一种局部、精准的肿瘤治疗手段,通过将光能转化为热能来杀死癌细胞,对正常组织损伤小。然而,传统有机光热制剂效率较低,往往需要高功率激光,存在安全隐患,限制了其临床转化。提高光热转换效率是推动该技术发展的关键。西安交通大学仿生工程与生物力学研究所(BEBC)靳国瑞教授、徐峰教授与香港中文大学(深圳)唐本忠院士等在ACS Nano期刊上发表题为“Tailoring Long-Lived Charge Separation Enables Efficient Light-to-Heat Conversion for Efficient Cancer Therapy”的研究论文。
该研究创新性地设计出一种名为MNTPAA的新型有机光热分子,在近红外光照射下实现了91.47%的超高光热转换效率,并在小鼠乳腺癌肿瘤模型中实现了肿瘤组织的完全消融,同时激活了抗肿瘤免疫反应,为防止肿瘤复发提供了新策略。
研究内容简介
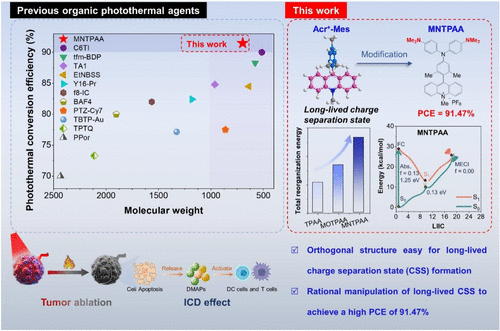
图1 分子设计示意图
研究团队从具有长寿命电荷分离特性的Acr⁺-Mes分子骨架出发,创新性地引入二甲基氨基取代的二苯胺供体单元,并利用空间正交锁定的分子构型,设计合成了MNTPAA分子。该设计通过增强分子运动、延长电荷分离态寿命,并将激发态能量有效地导向非辐射衰变途径,从而最大化热能产出。实验结果表明,MNTPAA在808 nm激光照射下表现出卓越的光热性能,溶液温度迅速上升,其光热转换效率高达91.47%。理论计算证实,MNTPAA具有最小的能隙和最大的重组能,分子运动显著,有利于将光能高效转化为热能。在细胞实验中,MNTPAA能快速被肿瘤细胞摄取,在低浓度光照下即可实现高效杀伤。进一步研究表明,其光热作用可同时诱发细胞坏死与凋亡。在4T1乳腺癌小鼠模型中,瘤内注射MNTPAA并照射激光后,肿瘤温度在4分钟内升至54.4°C,实现了肿瘤完全消融。该治疗还成功诱导了免疫原性细胞死亡,释放了CRT、HMGB1等免疫原性死亡信号,促进了树突状细胞的成熟,并招募了大量CD4⁺和CD8⁺ T细胞浸润肿瘤,重塑了肿瘤免疫微环境。
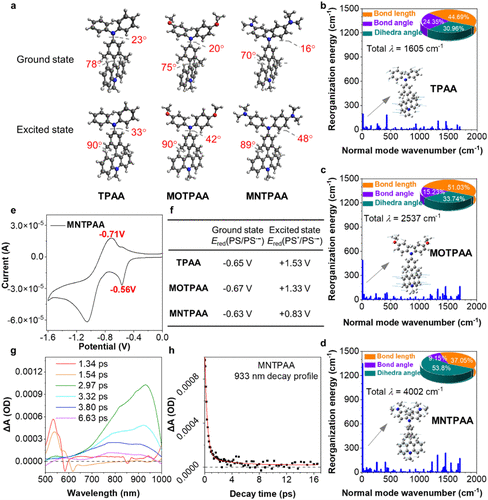
图2 MNTPAA高效光热转化效率的机理
该研究不仅开发了一种具有超高光热转换效率的新型分子,更展示了一种“分子构象调控电荷分离,增强非辐射衰变”的通用设计策略,为开发下一代高效、安全、兼具免疫调节功能的光热治疗制剂开辟了新思路。
西安交通大学生命学院博士生刘文婧、山东师范大学胡忠燕副教授、浙江大学张鉴予研究员和西北大学赵婧副教授为论文的共同第一作者,西安交通大学仿生工程与生物力学研究所(BEBC)靳国瑞教授、徐峰教授、华东师范大学胡连瑞教授和香港中文大学(深圳)唐本忠院士为论文的共同通讯作者。该研究得到了国家自然科学基金、国家重点研发计划、陕西省重点研发计划等多个项目的支持。
更多信息请访问:https://pubs.acs.org/doi/10.1021/acsnano.5c07765
BEBC理念
西安交通大学仿生工程与生物力学研究所(BEBC)围绕“重大疾病诊治”领域中共性科学问题和技术挑战,按照“临床重大需求牵引-生物力学理论创新-医工核心技术突破-临床转化应用推广”的研究思路,创立了“多尺度生物热-力-电耦合学”,开拓了“力-医学”学科新方向,提出了“细胞智能”颠覆性概念和技术。BEBC立足力学基础理论,交叉融合材料、化学、生物、医学等领域,按照“临床问题(BED)-实验室研究(BENCH)-临床应用(BED)”的研究思路,在力学微环境领域开展了从组织到细胞和分子尺度的多尺度生物热-力-电耦合学等基础和应用研究,为阐明重大疾病的发病机理和临床诊疗提供有效的理论指导和技术方案。
近年来,BEBC在生物力学和力学生物学的研究基础上,通过工程学手段,将不同尺度的力学调控引入疾病诊疗,开展了一系列的“力医学(mechanomedicine)”研究,同时正在结合数据科学与人工智能将智能算法融入临床医学,积极开拓基于AI赋能的“数智力医学”研究领域。相关代表性研究成果发表于《自然材料》(Nature Materials)、《自然化学》(Nature Chemistry)、《自然生物医学工程》(Nature Biomedical Engineering)、《自然通讯》(Nature Communications )、《科学进展》(Science Advances)、《美国科学院院报》(PNAS)等期刊。在国内医学权威期刊上系统阐释了力医学在不同疾病中的应用及前景。