癌细胞在转移过程受其所处物理微环境因素的影响,其中微环境的空间限制度和基质硬度已被证实可调控癌细胞的迁移能力。但由于缺乏可同时调控空间限制度(confinement)和基质硬度(stiffness)的体外细胞迁移检测平台,这两种细胞微环境因素对癌细胞迁移能力的协同调控作用仍未知。我们近期设计并制备了一种结合水凝胶生物材料和微流控技术的新型三维癌细胞迁移微流控芯片,实现了对微通道的空间限制度和硬度两个参数的单独调控。基于该三维癌细胞迁移微流控芯片,研究了乳腺癌细胞在不同物理微环境下的迁移能力,实验结果发现在高硬度微通道中细胞的迁移能力随通道宽度的减小而增强,并发生了向恶性、高侵袭性表型的转换,证实了目前有关空间限制度对癌细胞迁移能力影响的主流观点。另外,进一步的研究发现乳腺癌细胞在低硬度微通道中,通道空间限制度的提升并未引起癌细胞迁移能力的增强,也无法引发其向高侵袭性表型的转换。该结果表明癌细胞所处微环境的硬度对其迁移能力和表型转换有重要影响。最后,应用数学模型分析了癌细胞的迁移过程后,发现细胞核的变形在乳腺癌细胞感受胞外物理微环境、引发迁移模式转变当中发挥着重要作用。该研究不仅填补了目前体外实验平台无法同时模拟体内多种物理微环境因素的空白,为癌症迁移研究提供了一种高通量、高仿生性的实验平台,同时还发现了基质硬度在癌细胞恶性表型转化过程中的重要作用,为临床抗肿瘤迁移药物的研发和治疗提供了潜在的作用靶点。
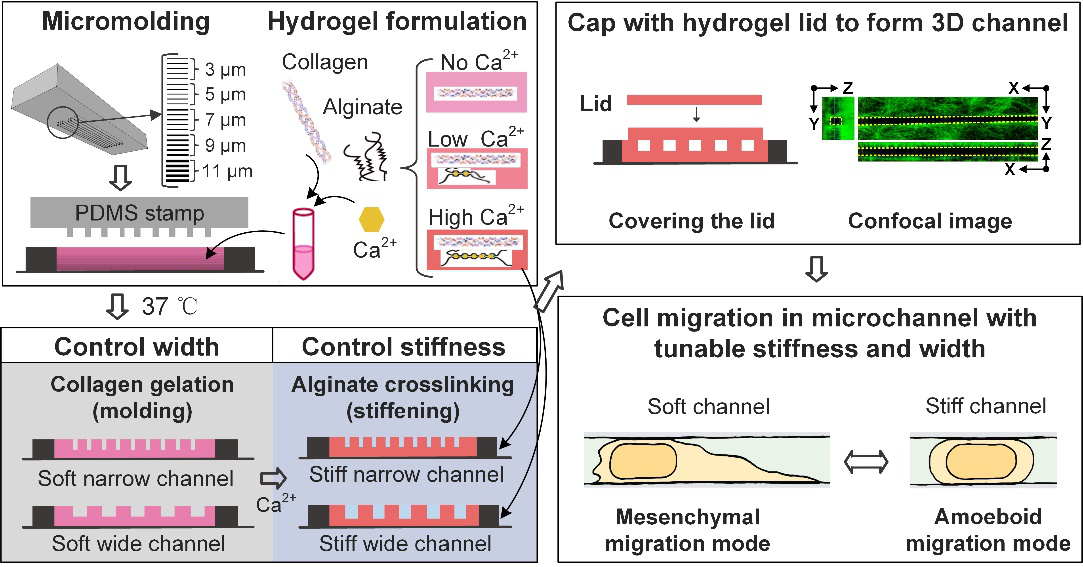
上述研究成果以“Microchannel stiffness and confinement jointly induce the mesenchymal-amoeboid transition of cancer cell migration”为题发表在NanoLetters上。博士生王蒙为第一作者,徐峰教授和李菲教授为本文的共同通讯作者,西安交通大学本文的第一和唯一通讯单位。该工作得到了国家自然科学基金等的支持。
文章链接:https://pubs.acs.org/doi/full/10.1021/acs.nanolett.9b01597